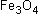
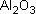
Chimie 3ème :
Pour réviser vos connaissances sur le cours n°1 "Les matériaux", faites les exercices 1,2 et 3 p 15.
Corrigé:
N° 1 : a) Le verre est un matériau. b) Le verre est un objet. c) Le plâtre est un matériau. d) Le plâtre est un objet. e) Le fer est un objet. f) Le fer est un matériau.
N° 2 : a) Matériaux métalliques / Matériaux
plastiques / Matériaux tirés d'êtres vivants / Les verres
et les céramiques ...
b) Règle en aluminium / Règle en polyéthylène /
Règle en bois / Carreaux de fenêtre en verre.
N° 3 : carton : rigidité
polyéthylène : étanchéité
aluminium : isole de la lumière, du dioxygène et des odeurs.
Pour réviser vos connaissances sur le cours n°2"Les atomes et les ions", faites les exercices 1 à 4 p 27.
Corrigé:
N°1 : a) Un électron est chargé négativement. b) Les électrons sont les constituants de l'atome. c) Le noyau d'un atome est chargé positivement. d) Un atome est électriquement neutre.
N°2 : a) Vrai. b) Tous les atomes ont un noyau différent (nombre de +). c) Le noyau d'un atome porte une charge électrique opposée à celle de l'ensemble des électrons de l'atome. d) Vrai.
N°3 : a) Un ion positif peut provenir d'un atome qui perdu des électrons. b) Un atome qui reçoit des électrons devient un ion négatif. c) Un ion est électriquement chargé.
N°4 :
| atome | électron | noyau | solution ionique |
| électriquement neutre | chargé négativement | chargé positivement | électriquement neutre |
Pour réviser vos connaissances sur le cours n°3"Le courant électrique", faites les exercices 1 à 4 p 36.
Corrigé:
N°1 : a) Dans un conducteur métallique, le courant électrique est un déplacement d'électrons libres. b) Une solution conductrice contient des ions, c'est une solution ionique. c) Un matériau isolant ne possède pas d'électrons libres, tous ses électrons sont des électrons liés.
N°2 : a) La flèche qui indique le sens du courant est la flèche rouge (à l'extérieur du générateur, le courant se déplace de la borne + vers la borne - : c'est le sens conventionnel.) b) La flèche qui indique le sens de déplacement des électrons est la flèche bleue puisque les électrons se déplacent de la borne - vers la borne +.
N°3 : a) Vrai (on est dans une solution ionique !). b) Faux, seuls les ions négatifs se déplacent vers la borne +. c) Faux, les ions positifs se déplacent vers la borne -. d) Faux, le courant électrique est dû à un déplacement d'ions. e) Vrai.
N°4 : a) Un métal conduit le le courant électrique car il contient des électrons libres. b) Une solution d'eau sucrée est isolante car elle contient des molécules. c) Une solution d'eau salée est conductrice car elle contient des ions (le sel) et des molécules (l'eau).
Pour réviser vos connaissances sur le cours n°4"La corrosion des métaux", faites les exercices 1 à 5 p 45.
Corrigé:
N°1 : a) La corrosion du fer est une oxydation qui nécessite trois réactifs : fer, eau et dioxygène. b) L'air est un mélange gazeux constitué principalement de diazote (4/5 en volume) et de dioxygène (1/5 en volume). Lorsque le fer rouille, c'est le dioxygène de l'air qui réagit.
N°2 : a) Vrai. b) Faux, la rouille étant poreuse, la corrosion se propage à l'intérieur du métal. c) Faux, c'est le dioxygène de l'air qui réagit avec le fer. d) Vrai, pour qu'il y ait de la rouille, il faut de l'eau.
N°3 : La corrosion du fer est une réaction chimique entre le fer et le dioxygène de l'air en présence d'eau. Elle conduit à la formation de la rouille.
N°4 : a) La corrosion de l'aluminium dans l'air entraîne la formation de l'oxyde d'aluminium. b) La couche d'oxyde d'aluminium est imperméable. c) La couche d'oxyde d'aluminium protège l'aluminium.
N°5 :
| Réaction | Réactifs | Produits |
| corrosion du fer | fer, dioxygène, eau | rouille (oxyde et hydroxyde de fer) |
| corrosion de l'aluminium | aluminium, dioxygène | oxyde d'aluminium |
Pour réviser vos connaissances sur le cours n°5"La combustion des métaux", faites les exercices 1 à 5 p 55.
Corrigé:
N°1 : Les métaux usuels réagissent vivement : a) avec l'air à chaud à l'état divisé (poudre). b) avec le dioxygène à chaud, même à l'état compact.
N°2 : Les réactions de combustion des métaux sont des réactions vives. a) Les produits formés lors de l'oxydation des métaux sont appelés oxydes métalliques. b) métal + dioxygène -> oxyde métallique.
N°3 : a) Faux, dans un oxyde métallique, il y a deux types d'atomes : les atomes du métal correspondant et les atomes d'oxygène. b) Vrai. c) Faux puisque la masse totale se conserve au cours d'une réaction chimique (par contre la masse des oxydes est supérieure à la masse du métal). d) Vrai puisque la masse des atomes d'oxygène s'ajoute à la masse du métal.
N°4 : En laissant traîner la souris (sans cliquer) sur les formules des oxydes avec un fond blanc, tu auras leur composition.
| 3 Fe | + | 2 | |
-> | 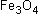 |
|
| 2 Zn | + | -> | 2 | Zn0 | ||
| 4 Al | + | 3 | |
-> | 2 | 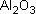 |
| 2 Cu | + | -> | 2 | CuO |
N°5 : Doc 1 p 50 : aluminium + dioxygène -> oxyde d'aluminium
(pour l'équation-bilan : voir la 3ème ligne de l'exercice 4)
Doc 2 p 50 : cuivre + dioxygène -> oxyde de cuivre (pour l'équation-bilan
: voir la 4ème ligne de l'exercice 4)
Doc 3 p 50 : zinc + dioxygène -> oxyde de zinc (pour l'équation-bilan
: voir la 2ème ligne de l'exercice 4)
Pour réviser vos connaissances sur le cours n°6"La combustion des matériaux organiques", faites les exercices 1 à 5 p 64.
Corrigé:
N°1 : a) Les matériaux organiques brûlent en consommant le dioxygène de l'air. La combustion complète produit essentiellement du dioxyde de carbone et de la vapeur d'eau. b)La combustion incomplète donne du monoxyde de carbone et des particules de carbone.
N°2 : a) Les réactifs sont le papier et le dioxygène. b) Les produits sont le dioxyde de carbone et la vapeur d'eau. c) Si la combustion est incomplète, il reste en fin de réaction des cendres noires (particules de carbone).
N°3 : a) La matière organique est essentiellement constitutée d'atomes de carbone et d'hydrogène. b) Ces atomes ont pour symbole C et H.
N°4 : a) Le dioxyde de carbone (![]() )
et l'eau (
)
et l'eau (![]() ) sont
les 2 produits qui se dégagent lors d'une combustion complète
d'une matière organique. b) Le carbone (C) et le monoxyde de carbone
(CO ) sont les 2 produits qui peuvent se dégager lors d'une combustion
incomplète d'une matière organique. c) Le dioxyde de carbone (
) sont
les 2 produits qui se dégagent lors d'une combustion complète
d'une matière organique. b) Le carbone (C) et le monoxyde de carbone
(CO ) sont les 2 produits qui peuvent se dégager lors d'une combustion
incomplète d'une matière organique. c) Le dioxyde de carbone (![]() )
est un gaz qui contribue à l'augmentation de l'effet de serre. d) Le
monoxyde de carbone (CO ) est un gaz toxique libéré lors d'une
combustion incomplète.
)
est un gaz qui contribue à l'augmentation de l'effet de serre. d) Le
monoxyde de carbone (CO ) est un gaz toxique libéré lors d'une
combustion incomplète.
N°5 : Certaines matières plastiques peuvent être constituées d'atomes de chlore ou d'azote... Lors de leurs combustions, des gaz très toxiques sont alors libérés.
Pour réviser vos connaissances sur le cours n°7"Quelques identifications ", faites les exercices 1, 4, 7 et 8 p 73.
Corrigé:
N°1 : a) L'acide chlorhydrique est une solution acide ; son pH est inférieur à 7. b) La soude est une solution basique ; son pH est supérieur à 7.
N°4 : Il faut approcher une flamme du récipient contenant le gaz, si on entend une petite détonation, le gaz est du dihydrogène.
N°7 : a) On utilise du nitrate d'argent pour tester la présence des ions chlorure. On utilise de la soude pour tester la présence des ions fer II et des ions zinc. b) On observera un précipité blanc noircissant à la lumière après avoir versé du nitrate d'argent dans une solution contenant des ions chlorure. On observera un précipité vert après avoir versé de la soude dans une solution contenant des ions fer II. On observera un précipité blanc après avoir versé de la soude dans une solution contenant des ions zinc.
N°8 :
| Ion | ||||
| Réactif | soude | nitrate d'argent | soude | soude |
| Couleur du précipité | vert | blanc | bleu | blanc |
Pour réviser vos connaissances sur le cours n°8"Réactions des matériaux métalliques avec les solutions", faites les exercices 2, 5 p 73 et 1 à 5 p 82.
Corrigé:
N°2 p 73: a) L'acide chlorhydrique attaque certains matériaux. b) La soude ne réagit pas avec le fer à l'état compact. c) Vrai. d) Faux, il se produit un dégagement de dihydrogène lorsqu'on fait réagir le zinc avec l'acide chlorhydrique. e) Faux, le chlorure de fer II donne un précipité vert avec la soude.
N°5 : La soude attaque l'aluminium. Il se produit un dégagement de dihydrogène. Lors de cette réaction chimique, l'aluminium et la soude sont les réactifs. Le dihydrogène est un produit de la réaction.
N°1 p 82 : L'acide chlorhydrique est une solution de chlorure d'hydrogène. Cette solution contient des molécules d'eau, des ions hydrogène car elle est acide, des ions chlorure d'après le test au nitrate d'argent. Elle contient autant d'ions hydrogène que d'ions chlorure. La solution est électriquement neutre.
N°2 : La réaction entre le zinc et l'acide
chlorhydrique produit des ions ![]() et du dihydrogène. Les ions
et du dihydrogène. Les ions ![]() de l'acide participent à la réaction (et se transforment en dihydrogène).
de l'acide participent à la réaction (et se transforment en dihydrogène).
N°3 : La réaction entre le fer et l'acide
chlorhydrique produit des ions ![]() et du dihydrogène. Les ions
et du dihydrogène. Les ions ![]() de l'acide ne réagissent pas (ions spectateurs).
de l'acide ne réagissent pas (ions spectateurs).
N°4 : En laissant traîner la souris (sans cliquer) sur les formules avec un fond blanc, tu auras leur composition.
| Fer | + | Acide chlorhydrique | -> | dihydrogène | + | chlorure | de | fer II | Commentaires : on écrit l'équation en toutes lettres |
| Fe | + | -> | + | + | On remplace par les formules chimiques | ||||
| On vérifie la neutralité électrique: il faut rajouter un porteur de - après la flèche. | |||||||||
| On vérifie la conservation des atomes : il y a un H avant la flèche et 2 après : on en rajoute un avant. Il y a un Cl avant et 2 après : on rajoute aussi Cl- | |||||||||
|
|
|||||||||
| Fe | + | 2 |
-> | + | 2 |
+ | Bilan : On compte le nombre de fois où chacune des espèces a été écrites | ||
| Fe | + | 2 |
-> | + | Bilan simplifié : On élimine
les espèces qui n'ont pas réagi. ( |
||||
| Zinc | + | Acide chlorhydrique | -> | dihydrogène | + | chlorure | de | zinc II | Commentaires : on écrit l'équation en toutes lettres |
| Zn | + | -> | + | + | On remplace par les formules chimiques | ||||
| On vérifie la neutralité électrique: il faut rajouter un porteur de - après la flèche. | |||||||||
| On vérifie la conservation des atomes : il y a un H avant la flèche et 2 après : on en rajoute un avant. Il y a un Cl avant et 2 après : on rajoute aussi Cl- | |||||||||
|
|
|||||||||
| Zn | + | 2 |
-> | + | 2 |
+ | Bilan : On compte le nombre de fois où chacune des espèces a été écrites | ||
| Zn | + | 2 |
-> | + | Bilan simplifié : On élimine
les espèces qui n'ont pas réagi. ( |
||||
N°5 : a) Pour identifier les ions chlorure, il doit verser quelques gouttes de nitrate d'argent dans un échantillon de sa solution, il obtiendra un précipité blanc noircissant à la lumière. b) Pour identifier les ions zinc II, il doit verser quelques gouttes de soude dans un échantillon de sa solution, il obtiendra un précipité blanc. c) Il verra son premier précipité noircir peu à peu.
Pour réviser vos connaissances sur le cours n°9"Réactions des matériaux non-métalliques avec les solutions", faites les exercices 3, 6 p 73.
Corrigé:
N°3 : a) Le zinc, le fer ou l'aluminium sont attaqués par l'acide chlorhydrique. b) Les matériaux calclaires (craie, marbre, ...) sont attaqués par les acides.
N°6 : a) Le zinc est attaqué par la soude. b) Par contre, le verre et les matières plastiques ne sont pas attaqués par la soude, on peut donc utiliser ces matériaux pour conserve la soude.